Habilidade: Calcular massas moleculares das substâncias a partir das massas atômicas dos elementos químicos constituintes.
Massa molecular é um termo usado exatamente para referir-se à massa de uma molécula, ou seja, de espécies químicas eletricamente neutras em que os átomos estão ligados por meio de ligações covalentes (com compartilhamento de elétrons).
No entanto, esse termo muitas vezes é usado também para referir-se à massa de fórmulas unitárias de espécies formadas por meio de ligações iônicas (com transferência definitiva de elétrons). Nesses casos, porém, o mais correto é usar o termo “massa-fórmula” no lugar de “massa molecular”.
Em ambos os casos, trata-se da soma das massas atômicas dos elementos que compõem a espécie química. Por exemplo, a massa molecular da molécula de monóxido de carbono (CO) é obtida somando-se a massa atômica de um carbono com a massa atômica de um oxigênio.
Mas o que é a massa atômica?
Essa grandeza é determinada experimentalmente e ela corresponde à massa do átomo comparada com um doze avos (1/12) da massa de um átomo de carbono 12, e a unidade adotada é o “u” (unidade de massa atômica). Convencionou-se que 1/12 da massa de 1 átomo de carbono doze é igual a 1 u (1,66 . 10⁻²⁴ g). Assim, quando dizemos que a massa atômica do oxigênio é 16 u, isso quer dizer que sua massa é 16 vezes maior que 1/12 da massa do ¹²C.
Portanto, a massa molecular também indica quantas vezes a massa da espécie química é maior que 1/12 da massa do isótopo do carbono-12. Visto que a massa atômica dos elementos é determinada experimentalmente, ela aparece na Tabela Periódica para cada elemento químico, como mostrado na figura ao lado.
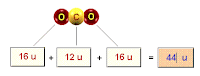
Assim, basta consultar a Tabela Periódica quando quisermos calcular a massa molecular de alguma substância. Por exemplo, no caso da molécula de CO, sua massa molecular é igual a:
MM (CO) = (massa atômica do C) + (massa atômica do O)
MM (CO) = (12 + 16) u
MM (CO) = 28 u
Geralmente, para cálculos estequiométricos, utiliza-se a unidade em gramas. Assim, temos que a massa molecular do CO pode ser dada por 28 g/mol.
Mas se a molécula possui mais de um átomo de cada elemento, é necessário multiplicar a massa atômica de tal elemento pela quantidade de átomos que aparecem na fórmula. Veja alguns exemplos:
MM (H2O) = (2 . 1 u) + (16 u)
M (H2O) = 18 u
MM(H2SO4) = (2 . 1 u) (32 u) + (4 . 16 u)
M (H2SO4) = 98 u
MM (C2H6)= (2 . 12) + (6 . 1)
MM (C2H6)= 30 u
MM (C12H22O11)= (12 . 12) + (22 . 1) + (11 . 16)
MM (C12H22O11)= 342 u
Veja como isso é feito para uma fórmula que possui parênteses, lembrando que o índice vale para todos os elementos que estão dentro dos parênteses. Os elementos devem ser multiplicados pelos seus respectivos índices:
MM (Al2(SO4)3) = Temos 2 Al, 3 S (porque o índice fora dos parênteses vale para ele também) e 12 O (porque multiplicamos os índices de fora dos parênteses pelo índice de dentro (4 . 3))
MM (Al2(SO4)3) = (2 . 27) + (3 . 32) + (12 .16)
MM (Al2(SO4)3) = 54 +96 + 192
MM (Al2(SO4)3) = 342 u
No caso de moléculas hidratadas, calcula-se separadamente a massa molecular da molécula e da água para depois somá-las, levando em consideração a quantidade de moléculas de água. Veja como isso é feito:
MM (CuSO4 . 5 H2O) = Cu S O4 . 5 H2O
MM (CuSO4 . 5 H2O) = (1.63,5) + (1.32) + (4.16) + 5 (1.2 + 1.16)
MM (CuSO4 . 5 H2O) = (63,5 + 32 + 64) + (5 . 18)
MM (CuSO4 . 5 H2O) = 159,5 + 90
MM (CuSO4 . 5 H2O) = 249,5 u
Fonte:
https://www.manualdaquimica.com/quimica-geral/massa-molecular.htm





Nenhum comentário:
Postar um comentário