Habilidade: Relacionar modelos de ligações químicas (iônica, covalente e metálica) com as propriedades das substâncias (temperatura de fusão e de ebulição, solubilidade, condutibilidade e estado físico à temperatura e pressão ambientes).
As Ligações Iônicas são as ligações químicas que ocorrem entre os átomos quando estes reagem entre si a fim de alcançarem a estabilidade.
Segunda a Teoria do Octeto, a estabilidade é atingida quando há 8 elétrons na última camada ou camada de valência.
Características das ligações iônicas
Diferentemente das ligações covalentes, em que há o compartilhamento de elétrons, nas ligações iônicas os elétrons são doados ou recebidos pelos átomos.
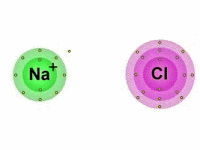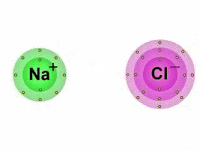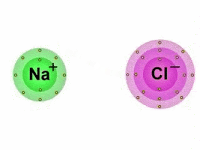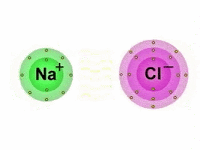
Também chamada de ligação eletrovalente, a ligação iônica é produzida entre íons (cátions e ânions), daí o termo "iônica".
Vale lembrar que os íons são átomos que possuem uma carga elétrica por adição ou perda de um ou mais elétrons.
Portanto, nas ligações iônicas, um ânion, íon de carga elétrica negativa, se une com um cátion, íon de carga positiva, formando assim, um composto iônico por meio da atração eletrostática existente entre eles.
 Assim, podemos concluir que a ligação iônica é um tipo de ligação química baseada na interação eletrostática que ocorre entre íons de cargas opostas, ou seja, íons positivos (cátions) e íons negativos (ânions).
Assim, podemos concluir que a ligação iônica é um tipo de ligação química baseada na interação eletrostática que ocorre entre íons de cargas opostas, ou seja, íons positivos (cátions) e íons negativos (ânions).
Dessa maneira, enquanto um átomo ganha elétrons, o outro perde elétrons.
Importante notar que, dos elementos que compõem a tabela periódica, aqueles que apresentam maior facilidade em perder elétrons, são em sua maioria, os metais das famílias IA (Metais Alcalinos), IIA (Metais Alcalino-Terrosos) e IIIA (família do Boro).
Por outro lado, os que possuem facilidade em ganhar elétrons são os ametais das famílias VA (família do Nitrogênio), VIA (Calcogênios) e VIIA (Halogênios).
Exemplos de Ligações Iônicas
As ligações iônicas, geralmente estabelecida entre um metal e um ametal (não metal), formam os compostos iônicos: elementos sólidos, duros e quebradiços que apresentam alto pontos de fusão e ebulição, além de conduzirem corrente elétrica quando dissolvidas em água.
Alguns exemplo de ligações iônicas:
Mg2⁺Cl⁻ = MgCl2 (Cloreto de Magnésio)
Al3⁺O2⁻ = Al2O3 (Óxido de Alumínio)
Fonte:







Nenhum comentário:
Postar um comentário