Mostrando postagens com marcador Ligações Iônicas. Mostrar todas as postagens
Mostrando postagens com marcador Ligações Iônicas. Mostrar todas as postagens
segunda-feira, 22 de agosto de 2022
segunda-feira, 7 de setembro de 2020
Ligações Iônicas
Habilidade: Relacionar modelos de ligações químicas (iônica, covalente e metálica) com as propriedades das substâncias (temperatura de fusão e de ebulição, solubilidade, condutibilidade e estado físico à temperatura e pressão ambientes).
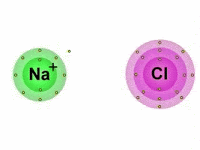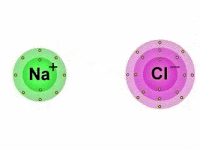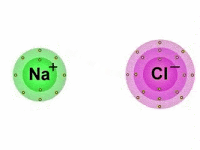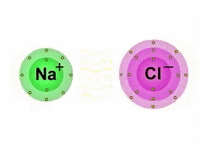
As Ligações Iônicas são as ligações químicas que ocorrem entre os átomos quando estes reagem entre si a fim de alcançarem a estabilidade.
Segunda a Teoria do Octeto, a estabilidade é atingida quando há 8 elétrons na última camada ou camada de valência.
Características das ligações iônicas
Diferentemente das ligações covalentes, em que há o compartilhamento de elétrons, nas ligações iônicas os elétrons são doados ou recebidos pelos átomos.
Também chamada de ligação eletrovalente, a ligação iônica é produzida entre íons (cátions e ânions), daí o termo "iônica".
Vale lembrar que os íons são átomos que possuem uma carga elétrica por adição ou perda de um ou mais elétrons.
Portanto, nas ligações iônicas, um ânion, íon de carga elétrica negativa, se une com um cátion, íon de carga positiva, formando assim, um composto iônico por meio da atração eletrostática existente entre eles.
 Assim, podemos concluir que a ligação iônica é um tipo de ligação química baseada na interação eletrostática que ocorre entre íons de cargas opostas, ou seja, íons positivos (cátions) e íons negativos (ânions).
Assim, podemos concluir que a ligação iônica é um tipo de ligação química baseada na interação eletrostática que ocorre entre íons de cargas opostas, ou seja, íons positivos (cátions) e íons negativos (ânions).
Dessa maneira, enquanto um átomo ganha elétrons, o outro perde elétrons.
Importante notar que, dos elementos que compõem a tabela periódica, aqueles que apresentam maior facilidade em perder elétrons, são em sua maioria, os metais das famílias IA (Metais Alcalinos), IIA (Metais Alcalino-Terrosos) e IIIA (família do Boro).
Por outro lado, os que possuem facilidade em ganhar elétrons são os ametais das famílias VA (família do Nitrogênio), VIA (Calcogênios) e VIIA (Halogênios).
Exemplos de Ligações Iônicas
As ligações iônicas, geralmente estabelecida entre um metal e um ametal (não metal), formam os compostos iônicos: elementos sólidos, duros e quebradiços que apresentam alto pontos de fusão e ebulição, além de conduzirem corrente elétrica quando dissolvidas em água.
Alguns exemplo de ligações iônicas:
Mg2⁺Cl⁻ = MgCl2 (Cloreto de Magnésio)
Al3⁺O2⁻ = Al2O3 (Óxido de Alumínio)
Fonte:
quinta-feira, 9 de outubro de 2014
Ligações Iônicas
A combinação
de átomos de cerca de 90 elementos químicos permite formar milhares de
substâncias, como os 4000 minerais conhecidos que estão presentes no solo.
O movimento
ordenado de elétrons que se deslocam por um fio é denominado corrente
elétrica.
 Nas ligações
iônicas, os materiais sólidos que não conduzem eletricidade, o fazem quando são
dissolvidos em água.
Nas ligações
iônicas, os materiais sólidos que não conduzem eletricidade, o fazem quando são
dissolvidos em água.
Os materiais desse grupo são denominados eletrólitos. Eletrólitos
são substâncias que, quando dissolvidas em água, tornam a solução condutora de
eletricidade.
Íons são átomos
ou grupos de átomos que ganharam ou perderam elétrons, ficando eletricamente
carregados, e que se unindo formam substâncias iônicas.
Existem dois
tipos de íon:
Cátions são
íons carregados positivamente.
Ânions são
íons carregados negativamente.
Substâncias
iônicas
Todas as
substâncias iônicas são formadas por cátions e ânions. E o total de cargas
positivas (cátions) é igual ao de negativas (ânions). Logo, as substâncias são eletricamente
neutras.
As formas
eletrostáticas (de atração e repulsão) existentes nas substâncias iônicas fazem
com que os íons sejam arranjados de forma organizada: ao redor dos cátions
estão ânions e ao redor dos ânions estão cátions. Essa organização é denominada
rede cristalina ou retículo cristalino.
Para que
ocorra condução de eletricidade é necessário que haja movimento de elétrons.
 Quando
uma substância iônica é adicionada à água, processo denominado hidratação,
cátions e ânions separam-se uns dos outros, podendo movimentar-se livremente. No
processo de hidratação ocorre uma separação dos íons, ou seja, há uma
dissociação iônica.
Quando
uma substância iônica é adicionada à água, processo denominado hidratação,
cátions e ânions separam-se uns dos outros, podendo movimentar-se livremente. No
processo de hidratação ocorre uma separação dos íons, ou seja, há uma
dissociação iônica. Nos sólidos
iônicos os cátions estão fortemente atraídos pelos ânions e não possuem
mobilidade. Por isso, os sólidos iônicos não conduzem eletricidade.
Nos sólidos
iônicos os cátions estão fortemente atraídos pelos ânions e não possuem
mobilidade. Por isso, os sólidos iônicos não conduzem eletricidade.
As forças
de atração e repulsão eletrostáticas dependem do tamanho e das cargas dos
átomos. O resultado do somatório dessas forças produz diferentes efeitos.
Ligação iônica
 Com a
formação dos íons, passa a existir atração eletrostática entre essas espécies
químicas: íons positivos (cátions) atraem íons negativos (ânions). Essa interação
entre cátions e ânions é denominada ligação iônica.
Com a
formação dos íons, passa a existir atração eletrostática entre essas espécies
químicas: íons positivos (cátions) atraem íons negativos (ânions). Essa interação
entre cátions e ânions é denominada ligação iônica.
Esse tipo
de ligação ocorre entre átomos que apresentam características opostas: os
metais, que apresentam alta eletropositividade, e os não-metais que apresentam
alta eletronegatividade. Na formação da ligação iônica, ou eletrovalente, os
metais cedem elétrons e os não-metais recebem elétrons.
Possuem altos
pontos de fusão e de ebulição, por causa da forte atração entre os íons
vizinhos de cargas opostas, e tendem a ser sólidas nas condições ambientais.
Exemplos de
substâncias iônicas:
Cloreto de
sódio, NaCl.
Brometo de
potássio, KBr.
Cloreto de
magnésio, MgCl2.
Óxido de
alumínio, Al2O3.
Teoria do
octeto:
O postulado
básico da teoria do octeto diz que os átomos se tornam estáveis quando adquirem
a estrutura eletrônica do gás mais próximo na tabela periódica. Para tal, os
átomos podem ganhar ou perder elétrons.
Teoria do
orbital molecular:
A capacidade
de ligação dos átomos está relacionada diretamente com o número de elétrons
presentes em seus níveis mais externos e que vão participar das ligações
químicas.
Valência é
o número de elétrons que os átomos de um elemento químico possuem no nível mais
externo, também denominado camada de valência.
Fonte: CANTO, Eduardo Leite do. Ciências Naturais: Aprendendo com o
cotidiano. São Paulo: Editora Moderna, 2012.
Fonte: SANTOS & MOL. Química Cidadã: Volume 1. São Paulo: Editora
AJS, 2013.
Fonte: SILVA, Eduardo Roberto da & HASHIMOTO, Ruth R. Cursos
Práticos Nova Cultural – Vestibular. Química.
Fonte: Material de apoio ao currículo do Estado de São Paulo: Caderno do
Professor, Química, Ensino Médio, 2ª Série. São Paulo: SE, 2014.
Assinar:
Postagens (Atom)