Objetivo:
Estudar os fatores que alteram a velocidade de uma reação química.
1º Experimento: Superfície de contato
b. Adicionar em cada béquer 10 mL de água.
c. Em um dos copos, adicione uma pastilha inteira de antiácido.
d. No outro, adicione uma pastilha de antiácido pulverizada.
e. Observar e anotar no relatório.
2º Experimento: Temperatura
b. No tubo 1 adicionar aproximadamente 5 mL de água gelada e no tubo 2, adicionar aproximadamente 5 mL de água quente.
c. Em seguida, colocar 1 espátula de antiácido em pó em cada um dos tubos.
d. Observar e anotar no relatório.
3º Experimento: Catalisador
a. Separar 2 tubos de ensaio.
b. No tubo 1, colocar com a pipeta graduada 5 mL de água oxigenada (H2O2).
c. No tubo 2, colocar com a pipeta graduada 5 mL de água oxigenada, em seguida, colocar no tubo, um pedaço de batata crua.
d. Observar e anotar no relatório.
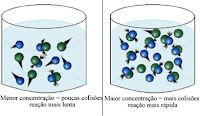
4º Experimento: Concentração dos reagentes
a. Coloque duas colheres de vinagre em um copo e quatro colheres de vinagre em outro copo.
b. Adicione a mesma quantidade de água em temperatura ambiente em cada copo.
c. Ao mesmo tempo, acrescente uma colher de bicarbonato de sódio em cada copo.
d. Observar e anotar no relatório.
Relatório
1º Experimento
a) Quanto a 1ª experiência, qual foi a diferença observada entre o que ocorreu no tubo 1 em relação ao tubo 2. Justifique.
b) A superfície de contato provocou aumento ou diminuição da velocidade da reação?
2º Experimento
a) No tubo 2 da experiência 2 a efervescência foi menor ou maior em relação ao tubo 1?
b) O fator que influenciou essa reação foi a:
( ) superfície de contato
( ) temperatura
( ) catalisador
c) A quantidade mínima de energia necessária para que as moléculas possam reagir chama-se __________
3º Experimento
a) Na experiência 3 observa-se que a reação no tubo 2 ocorre com menor ou maior velocidade em relação ao tubo 1?
b) Isso se deve a ação do catalisador presente na:
( ) batata crua
( ) água oxigenada
4º Experimento
Com relação à experiência 4, responda:
a) O que está evidenciando a reação?
b) Em qual tubo é mais intensa a reação?
c) Qual fator está influenciando a velocidade da reação?
Fonte:
https://pt.slideshare.net/blackbirdbr/modelo-de-transformaes-qumicas-rapidez-ou-velocidade-das-reaes