A velocidade das reações químicas é uma área estudada pela Cinética Química. Esse estudo é importante porque é possível encontrar meios de controlar o tempo de desenvolvimento das reações, tornando-as mais lentas ou mais rápidas, conforme a necessidade.
Temperatura:
um aumento na temperatura provoca um aumento na velocidade das reações químicas, sejam elas endotérmicas ou exotérmicas, pois isso faz com que se atinja mais rápido o complexo ativado.
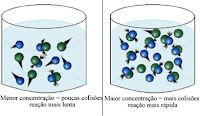
um aumento na concentração dos reagentes acelera a reação, pois haverá um maior número de partículas dos reagentes por unidade de volume, aumentando a probabilidade de ocorrerem colisões efetivas entre elas.
Pressão:
 Esse fator interfere unicamente em sistemas gasosos. O aumento da pressão aumenta também a rapidez da reação, pois deixa as partículas dos reagentes em maior contato.
Esse fator interfere unicamente em sistemas gasosos. O aumento da pressão aumenta também a rapidez da reação, pois deixa as partículas dos reagentes em maior contato.
Superfície de contato:
Quanto maior a superfície de contato, maior a velocidade com que a reação se processa, pois, conforme explicado nos dois últimos itens, a reação depende do contato entre as substâncias reagentes.
Catalisador:
O uso de catalisadores específicos para determinadas reações pode acelerá-las. Essas substâncias não participam da reação em si, pois são totalmente regeneradas ao final dela.
 Além desses fatores principais, a natureza dos reagentes e fatores externos como luz e eletricidade podem influenciar a velocidade de certas reações químicas. A natureza do reagente interfere porque quanto maior for o número de ligações dos reagentes que precisam ser rompidas para que a reação ocorra e também quanto mais fortes elas forem, mais lenta será a reação.
Além desses fatores principais, a natureza dos reagentes e fatores externos como luz e eletricidade podem influenciar a velocidade de certas reações químicas. A natureza do reagente interfere porque quanto maior for o número de ligações dos reagentes que precisam ser rompidas para que a reação ocorra e também quanto mais fortes elas forem, mais lenta será a reação.
Já a luz influencia em reações fotoquímicas, em que há algum reagente fotoquimicamente ativo. Um exemplo é a fotossíntese, que não ocorre sem as radiações luminosas captadas pela clorofila das plantas — o pigmento responsável pela cor verde.
 Outro exemplo é a decomposição da água oxigenada, que ocorre com maior rapidez se houver luz. É por isso que os frascos que contêm esse produto são sempre escuros ou opacos, impedindo a entrada de luminosidade.
Outro exemplo é a decomposição da água oxigenada, que ocorre com maior rapidez se houver luz. É por isso que os frascos que contêm esse produto são sempre escuros ou opacos, impedindo a entrada de luminosidade.
Fonte bibliográfica:
https://mundoeducacao.bol.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm
http://www2.fc.unesp.br/lvq/animations.htm
https://educador.brasilescola.uol.com.br/estrategias-ensino/exemplo-reacao-decomposicao.htm





Nenhum comentário:
Postar um comentário